Теория металлургических процессов. Учебное пособие: Теория металлургических процессов. Южно-Уральский государственный университет
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Южно-Уральский государственный университет
Филиал в г. Златоусте
Кафедра «Общая металлургия»
669. 02/ . 09 (07)
Д463
ТЕОРИЯ МЕТАЛЛУРГИЧЕСКИХ ПРОЦЕССОВ
Учебное пособие
Челябинск
Издательство ЮУрГУ
ВВЕДЕНИЕ
Металлургические процессы – это совокупность физических явлений и физико-химических превращений (движение газов, жидких и твердых материалов, тепло - и массообмен, фазовые переходы, окисление и восстановление материалов и т. п.), происходящих в металлургических агрегатах (доменная печь, агломерационная машина, сталеплавильная и нагревательная печи, конвертер) при высоких температурах. Предметом изучения курса «Теория металлургических процессов» являются реакции, протекающие в указанных металлургических агрегатах.
Курс ТМП занимает особое положение среди всех металлургических дисциплин, по сути, он является прикладной физической химией применительно к анализу явлений, происходящих при производстве чугуна, стали и ферросплавов.
Теоретические основы металлургических процессов рассматриваются в определенной последовательности: вначале на основе законов термодинамики анализируются условия равновесия химических процессов, затем – кинетика и особенности механизма процессов. Эти вопросы и являются основными задачами, решаемыми при изучении курса ТМП.
1. СОСТАВ И СВОЙСТВА ВЫСОКОТЕМПЕРАТУРНОЙ ГАЗОВОЙ АТМОСФЕРЫ
1.1. Термодинамика газовых атмосфер
Пирометаллургические процессы производства металлургических расплавов (чугун, сталь, сплав) протекают с участием газовых атмосфер, которые могут быть нейтральными, окислительными и восстановительными.
Состав, давление и температура газовой фазы зависят от характера ее взаимодействия с другими фазами, образующимися при получении металлов и сплавов. При этом как промежуточный, так и полный состав газовой фазы весьма однотипен:
продукты полного взаимодействия элементов с кислородом – CO2, H2O(пар), SO3;
продукты неполного взаимодействия с кислородом, диссоциации оксидов и дегазации металлов – CO, SO2, H2, O2, N2, CH4; инертные газы – Ar, Kr.
Равновесный состав газовой фазы можно рассчитать на основе термодинамического анализа химических реакций, важнейшими из которых являются реакции взаимодействия с кислородом водорода , окиси углерода, метана и сернистого ангидрида.
Данные обратимые реакции описываются следующими химическими уравнениями (на 1 моль О2):
2H2 + O2 = 2H2O(пар) , | Дж; | |
2СО + O2 = 2СО2, | Дж; | |
2СH4 + O2 = 2СО + 4H2O, | Дж; | |
1/2СH4 + O2 = 1/2СО2 + Н2О, | Дж; | (1.4) |
2SO2 + O2 = 2SO3, | Дж. |
Термодинамический анализ данных обратимых реакций позволяет установить равновесные содержания и парциальные давления молекулярного кислорода, а также охарактеризовать окислительно-восстановительные свойства газовой фазы в указанных реакциях.
Однако более важной термодинамической характеристикой, которая определяет направление протекания химических реакций, является изменение энергии Гиббса D GТ, стандартное изменение которой D G° Т, в зависимости от температуры для реакций (1.1)–(1.5) имеет вид, Дж:
D G° (1.1) = - + 108 Т;
D G° (1.2) = - + 175 Т;
D G° (1.3) = - + 370 Т;
D G° (1.4) = - + 2 Т;
D G° (1.5) = - + 196 Т.
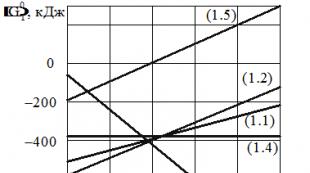
На рис. 1.1 представлены графики этих зависимостей.

Рис. 1.1. Стандартная энергия Гиббса для реакций горения
Указанные зависимости справедливы при температуре до 2500 К и общем давлении в системе Р=1 атм., т. е. до процессов диссоциации H2О, O2, Н2 на атомы, их ионизации и образования плазмы.
Из анализа приведенных зависимостей и графиков вида D G° Т = f(Т) на рис. 1.1 следует, что с повышением давления равновесие реакций (1.1), (1.2) и (1.5) смещается в прямом направлении, а с повышением температуры полнота протекания этих реакций уменьшается. Изменение давления не влияет на равновесие реакции (1.4), а прямой ход реакции (1.3) с увеличением давления замедляется. С повышением температуры реакции (1.3) и (1.4) характеризуются большей полнотой протекания.
Равновесный состав образовавшейся атмосферы и парциальные давления ее составляющих компонентов позволят определить и рассчитать окислительно-восстановительные свойства (ОВС) газовой фазы, воздействующей на способные к окислению или восстановлению материалы гетерогенной системы.
Простейшей количественной характеристикой ОВС какой-либо газовой смеси является равновесное парциальное давление кислорода . Однако более точной оценкой ОВС газовой атмосферы является ее кислородный потенциал p О, представляющий собой величину химического потенциала молекулярного кислорода при отсчете его от стандартного состояния, при котором DIV_ADBLOCK144">
Величина p О зависит от температуры и от состава газовой фазы, который выражается через отношение парциальных давлений реагентов, влияющих на .
В металлургических агрегатах газовые атмосферы состоят из множества компонентов, которые постоянно участвуют в физико-химических превращениях. Термодинамический анализ таких систем основывается на утверждении, что сложное химическое равновесие достигается в результате одновременного установления в системе всех возможных частных равновесий.
Так, при одновременном протекании в газовой фазе реакций (1.1)–(1.5) при T=const давления указанных компонентов примут значения, соответствующие константам равновесия КР(1.1)–КР(1.5), а кислородный потенциал газовой смеси
может быть рассчитан по данным любого из этих равновесий, например, по уравнению
В рассматриваемой восьмикомпонентной газовой смеси помимо реакций (1.1)–(1.5) возможны и другие химические взаимодействия между реагентами. Наибольший интерес представляет так называемая реакция водяного газа (водяным газом называют смесь четырех газов Н2 – Н2О – СО – СО2):
Н2 + СО2 = Н2О + СО, D G° (1.5) =- 33,5T Дж. (1.8)
Анализ этой реакции исключительно важен в металлургии для оценки равновесий в газовых атмосферах при использовании природного газа или увлажненного дутья в доменной печи, других металлургических агрегатах.
Для определения равновесного состава системы реакции (1.8) нужно задаваться не только значением константы равновесия
 (1.9)
(1.9)
и общим давлением
(1.10)
но и еще двумя какими-либо условиями, что следует из анализа числа степеней свободы:
С = p + 2 - Ф = 3 + 2 - 1 = 4.
На практике чаще всего задают исходный состав системы или парциальные давления паров в исходной смеси. В нашем случае кроме Р и Т в качестве двух переменных можно выбрать не изменяющиеся числа молей углерода и водорода или не изменяющиеся суммы парциальных давлений водорода и углеродсодержащих газов:
 (1.11)
(1.11)
 (1.12)
(1.12)
Совместное решение уравнений (1.9)–(1.12) позволяет найти равновесный состав газовой смеси. Результаты расчетов можно представить графически, при этом исходными данными являются соотношения:
 (1.13)
(1.13)
Из графика (рис. 1..gif" width="69" height="28"> и наоборот. После вычисления равновесного значения %СО / %СО2 (или %Н2 / %Н2О) можно определить кислородный потенциал системы СО – СО2 – Н2 – Н2О и нанести на рис. 1.2 линии постоянных значений p О.

Рис. 1.2. Соотношение между %СО / %СО2 и %Н2 / %Н2О.
1.2. Гомогенные газовые процессы
Термодинамический анализ реакций, протекающих в сложных газовых атмосферах, позволяет лишь судить о возможности протекания реакции в прямом или обратном направленях и рассчитать состав газовой фазы. Однако при этом невозможно рассмотреть механизм процессов взаимодействия и провести их кинетический анализ.
Механизм взаимодействия валентно насыщенных молекул должен включать разрыв или ослабление валентных связей. Это требует больших энергетических затрат, что не может быть компенсировано только энергией теплового движения молекул. Как показывают экспериментальные данные, все реакции горения имеют цепной механизм, характеризующийся участием активных центров (частиц) – атомов и радикалов со свободными валентностями. Простейшие акты многостадийного процесса окисления начинаются после образования активных центров и протекают как химические реакции между ними и молекулами с небольшой энергией активности. Особенностью таких реакций является воспроизводство активных центров. По характеру своего протекания цепные реакции делятся на неразветвленные, разветвленные и с вырожденным разветвлением.
Вообще же модельной в теории цепных реакций является наиболее изученная реакция горения водорода, для которой характерно малое число промежуточных продуктов и хорошо выделяемые элементарные акты. Ими являются:
1) реакции образования активных центров в объёме смеси и на стенке сосуда:
![]()
![]() Е1.14 = 198,55 кДж/моль; (1.14)
Е1.14 = 198,55 кДж/моль; (1.14)
![]()
![]() Е1.15 = 180,7 кДж/моль; (1.15)
Е1.15 = 180,7 кДж/моль; (1.15)
Надс + О2 = НО2; (1.16)
2) реакция продолжения цепи:
https://pandia.ru/text/79/398/images/image020_45.gif" width="172" height="48 src="> Е1.17=41,9кДж/моль; (1.17)
3) реакции разветвления цепей:
![]()
![]() Е1.18 = 63,27 кДж/моль; (1.18)
Е1.18 = 63,27 кДж/моль; (1.18)
![]()
![]() Е1.19 = 25,14 кДж/моль; (1.19)
Е1.19 = 25,14 кДж/моль; (1.19)
4) реакция обрыва цепей (дезактивации) на стенке
![]()
![]() ; (1.20)
; (1.20)
5) реакция обрыва цепей в объеме газовой фазы (М – нейтральная молекула):
![]() Е(1.21) »
0; D
Н1.20 = -
197 кДж/моль. (1.21)
Е(1.21) »
0; D
Н1.20 = -
197 кДж/моль. (1.21)
Скорость каждой из указанных реакций определяется парциальным давлением Р и порядком реакции n и в общем виде может быть представлена в виде
V = const × https://pandia.ru/text/79/398/images/image029_30.gif" width="411 height=267" height="267">
Рис. 1.3. Условия воспламенения газовой смеси (Н2 + О2)
2. АНАЛИЗ ПРОЦЕССОВ ГОРЕНИЯ ТВЕРДОГО УГЛЕРОДА
Из возможных взаимодействий углерода с окислителями рассмотрим наиболее важные.
1. Реакция неполного сгорания углерода
2С + О2 = 2СО, D G° Т(2.1) = - - 180Т Дж/моль. (2.1)
2. Реакция полного сгорания
С + О2 = СО2, D G° Т(2.2) = - - 2,3Т Дж/моль. (2.2)
3. Реакция газификации углерода паром Н2О до СО
2С + 2Н2О = 2СО + 2Н2, D G° Т(2.3) = - 288Т Дж/моль. (2.3)
4. Реакция газификации углерода паром Н2О до СО2
С + 2Н2О = СО2 + 2Н2, D G° Т(2.4) =- 110,6Т Дж/моль. (2.4)
5. Реакция газификации углерода
С + СО2 = 2СО, D G° Т(2.5) = - 177,7Т Дж/моль. (2.5)
Наибольший интерес представляет реакция (2.5), являющаяся эндотермической: D Н° = 172,6 кДж.
По отношению , которое устанавливается реакцией газификации углерода, можно судить о влиянии твердого углерода на состав газовой фазы системы С - СО - СО2 в широком температурном интервале. Равновесный состав этой газовой атмосферы представлен на рис. 2.1.
Согласно принципу Ле Шателье повышение давления смещает равновесие реакции газификации углерода влево, то есть при неизменной температуре равновесная газовая смесь обогащается двуокисью СО2. При понижении давления концентрация СО в газовой фазе увеличивается.
Гетерогенный процесс взаимодействия углерода с окислителем состоит из ряда стадий:
2) молекулярная диффузия через гидродинамический слой толщиной d Г, где сохраняется ламинарное течение;
3) адсорбция окислителя на поверхности углерода;
4) химическое взаимодействие с образованием адсорбированных продуктов (СО2 при низких температурах и СО при высоких);
5) десорбция продуктов реакции;
6) диффузия (молекулярная и турбулентная) продуктов реакции в газовый поток.

Рис. 2.1. Состав газовой атмосферы (СО - СО2) в равновесии с твердым углеродом
Лимитирующей в процессе окисления углерода является адсорбционно-кинетическая стадия, объединяющая в себе стадии 3, 4 и 5. Лимитирующей может быть и молекулярная диффузия.
Скорость диффузии в расчете на единицу поверхности можно рассчитать по формуле
![]() (2.6)
(2.6)
где D – коэффициент диффузии, b – коэффициент массопереноса, Со и Спов – концентрация окислителя в объеме газовой фазы и на поверхности углерода, соответственно.
Скорость химического взаимодействия определяется концентрацией адсорбированного реагента Спов:
![]() (2.7)
(2.7)
где К – константа скорости реакции, зависящая экспоненциально от температуры энергии активации процесса, n – порядок реакции (в данном случае n = 1).
Если процесс взаимодействия углерода с газовой фазой происходит в стационарном режиме, т. е. без изменения скорости во времени, то скорость этого процесса Vпроц определяется как
Vпроц = V х. р = VD. (2.8)
Подставляя в (2.8) соотношения (2.6) и (2.7), в итоге получаем наблюдаемую скорость процесса окисления углерода:
 (2.9)
(2.9)
В зависимости от соотношения величин К и b возможны следующие режимы окисления:
– кинетический при b >>K;
– диффузионный при К>>b ;
– диффузионно-кинетический при К » b .
Термодинамический анализ реакции (2.5) позволяет выявить условия распада монооксида углерода. Это возможно в газовых атмосферах с большим отношением и при понижении температуры. Величина D G° Т для реакции
2СО = СО2 + С
уменьшается с понижением температуры, но кинетически без катализатора осуществить данную реакцию, используемую, например, в процессе цементации, затруднительно.
Для окисления связи «С - О» в молекуле СО нужна каталитическая твердая поверхность, наиболее сильным катализатором является железо. При этом основными стадиями процесса распада СО с образованием твердого мелкодисперсного углерода будут следующие:
1) адсорбция молекулы СО на поверхности катализатора, приводящая к ослаблению связи «С - О»;
2) процесс распада при ударе активной молекулы СО газовой фазы об адсорбированную по реакции
СО + Соадс = СО2 + С.
3. ОЦЕНКА ПРОЧНОСТИ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Процессы диссоциации важнейших для металлургии соединений – оксидов, нитридов, карбонатов – являются весьма важными, поскольку являются прямым способом получения металлов. Данные процессы весьма однотипны, и в зависимости от температуры их можно представить уравнениями вида:
АВтв = Атв + Вгаз;
АВтв = Аж + Вгаз;
АВж = Атв + Вгаз;
АВж = Аж + Вгаз.
Величина равновесного парциального давления газообразного продукта этих реакций называется упругостью диссоциации соединения АВ и характеризует прочность данного соединения. Реакции диссоциации являются эндотермическими, т. е. с повышением температуры равновесие смещается в сторону продуктов реакции. Уменьшение давления при сохранении состава газовой фазы оказывает аналогичное действие.
Согласно правилу фаз Гиббса, число степеней свободы для реакций диссоциации определяется как
С = К + 2 - Ф = 2 + 2 - 3 = 1,
т. е. для количественной характеристики достаточно лишь одного независимого параметра – температуры, от которой зависит константа равновесия процесса:
Кр = РВ = ¦ (Т).

Рис. 3.1. Зависимость упругости диссоциации соединения АВ от температуры
На рис. 3.1 представлена зависимость РВ от температуры для указанных реакций.
3.1. Диссоциация карбонатов
В черной металлургии наибольший практический интерес представляет анализ реакции диссоциации карбонатов кальция СаСО3, магния MgCO3, марганца MnCO3, железа FeCO3 (сидерит) и доломита CaMg(CO3)2. Процессы диссоциации этих соединений однотипны и протекают по уравнению:
MeCO 3 = MeO + CO 2,
Величина является упругостью диссоциации карбоната и характеризует меру химической прочности соединения.
Наибольший интерес представляет реакция диссоциации карбоната кальция, который входит в состав шихтовых материалов доменного и сталеплавильного производства, а также используется для получения СаО через обжиг известняка.
Реакция диссоциации СаСО3 описывается уравнением вида
СаCO 3 = СаO тв + CO 2, = Дж; (3.1)
D G ° Т = - 150 Т; Kp(3.1) =
Зависимость упругости диссоциации карбоната от температуры представлена на рис. 3.2.

Рис. 3.2. Упругость диссоциации СаСО3
Анализ данной графической зависимости с использованием изотермы химической реакции показывает, что диссоциация карбоната возможна, когда фактическое значениеменьше равновесного и при этом D G° Т < 0. Температура, при которой возможен этот процесс, является температурой начала диссоциации ТНД.
Любая фигуративная точка 1 выше равновесной линии на рис. 3.2 отвечает устойчивому существованию карбоната СаСО3. Любая фигуративная точка 2 ниже линии отвечает устойчивому существованию оксида СаО.
Процесс диссоциации карбоната протекает с высокой скоростью при температурах выше температуры химического кипения ТХК, при которой упругость диссоциации становится равной общему внешнему давлению газовой фазы.
3.2. Диссоциация оксидов железа
Термодинамика процессов диссоциации оксидов аналогична процессу диссоциации карбонатов, особенности связаны лишь с наличием у некоторых металлов различной степени валентности – в частности, у оксидов железа.
В соответствии с принципом Байкова, диссоциация оксидов железа происходит последовательно, от высшего к низшему вплоть до образования металла. Реакции диссоциации имеют следующий вид:
6Fe2O3 = 4Fe3O4 + O2, D G ° Т = - 281,3 Т Дж ; (3.2)
2Fe3O4 = 6FeO + O2, D G ° Т = - 250,2 Т Дж ; (3.3)
2FeO = Fe + O2, D G ° Т = - 130,7 Т Дж ; (3.4)
1/2Fe 3O 4 = 3/2Fe + O 2, D G ° Т = - 160,2 Т Дж. (3.5)
Указанные оксиды существуют в определенных температурных интервалах. На рис. 3.3 представлены графики зависимостей D G° Т от температуры реакций (1)–(4).

Рис. 3.3. Стандартная энергия Гиббса реакций диссоциации оксидов железа
По рассчитанным величинам упругостей диссоциации построены зависимости ![]() представленные на рис. 3.4.
представленные на рис. 3.4.

Рис. 3.4. Области устойчивого существования
железа и его оксидов
На данной диаграмме указаны области устойчивого существования чистого железа и его оксидов в широком температурном интервале. Точка O соответствует нонвариантному равновесию с параметрами Т = 575° С и » - 26 (в равновесии находятся четыре фазы – твердые Fe, FeO, Fe3O4 и О2). На остальных линиях реализуется нонвариантное равновесие. Любая точка между линиями отвечает фиксированному состоянию бивариантной системы, что позволяет определить условия устойчивого существования данной конденсированной фазы.
3.3. Механизм и кинетика процессов диссоциации
Отличительными особенностями процессов диссоциации, протекающих по реакции вида
АВтв ® Атв + Вгаз,
являются:
– наличие процесса зарождения новой твёрдой фазы;
– локализация процесса на границе раздела «старой» и «новой» твёрдых фаз;
– зависимость скорости процесса от степени превращения.
В качестве характеристики такого процесса применяют степень превращения a :
где mAB (p ) , mAB (исх) – равновесное и исходное значения соединения АВ.
Степень превращения a зависит от времени процесса, что подтверждено многочисленными экспериментальными данными (рис. 3.5).
font-size:13.0pt;letter-spacing:-.1pt">Рис. 3.5. Изотермические зависимости степени превращения
a
от времени
и скорости превращения от степени превращения
При этом можно выделить три этапа:
I – индукционный период, характерный невысокими скоростями процесса из-за трудностей зарождения новой фазы;
II – автокатализ, связанный с ускорением реакции диссоциации;
III – период завершения процесса, что связано с уменьшением количества старой фазы и поверхности раздела.
Экспериментальные исследования процессов диссоциации свидетельствуют о протекании такого процесса по схеме
АВтв ® Атв× Вгаз(адс) ® Атв + Вгаз.
При этом образование зародыша новой фазы в недрах старой должно сопровождаться уменьшением энергии Гиббса системы, рассчитываемой по уравнению
D G = D GV + D GW,
где D GV и D GW – объёмная и поверхностная составляющие общего изменения энергии Гиббса.
Значения D GV и D GW определяются как
D
GV
= ![]()
D GW = S × s ,
где V и S – объём и поверхность зародыша новой фазы, r и М – плотность и молекулярная масса новой фазы, s – поверхностное натяжение, m 2 и m 1 – химические потенциалы соединения АВ в новой и старой фазе.
![]()
Из анализа данного соотношения следует, что самопроизвольно процесс образования новой фазы возможен при определённом соотношении m 2 и m 1.
При Т £ Тнд m 2 ³ m 1, и в этом случае появление зародыша любого размера термодинамически невозможно.
Если же Т > Тнд, то m 2 >m 1, и слагаемые в формуле для D G имеют разный знак, поскольку с ростом r первое слагаемое растёт по абсолютной величине быстрее, то и кривая D G = f (r ) имеет максимум, положение которого определяет величину критического зародыша, рост которого сопровождается уменьшением энергии системы. При некоторых условиях зародыш новой фазы становится термодинамически устойчив. Степень перегрева соединения АВтв определяет как радиус критического зародыша, так и его стабильность. Для определения размера критического зародыша необходимо исследовать функцию D G = f (r ) на экстремум, после чего получим

Величина D m = m 1 – m 2 называется химическим пресыщением и является движущей силой процесса диссоциации.
На рис. 3.6 показано условие возникновения и роста зародыша новой фазы.
Из анализа зависимостей следует, что при прочих равных условиях, чем больше перегрев, тем меньше критический зародыш и легче (быстрее) идёт процесс диссоциации соединений.

Рис. 3.6. Условия роста зародыша новой фазы
Таким образом, рост зародыша новой среды зависит от температуры, времени и подвижности частиц, образующих новую среду. Изучение механизма конкретного превращения позволяет определить аналитические зависимости, однако они приемлемы, как правило, только для анализируемого случая. При этом необходимо учитывать естественные затруднение роста, связанные с «перекрытием » зародыша новой фазы и лимитирования процесса какой-либо элементарной его стадией.
Реальные системы существенно могут отличаться от создаваемых моделей диссоциации, при создании которых следует обращать внимание на следующие особенности: в начальный момент времени возможны более медленный рост зародышей; поверхностная скорость продвижения границы раздела фаз может отличаться от скорости проникновения в объем; реакционная способность границы изменяется во времени; объем продуктов и реагентов могут не совпадать; при обратимых реакциях возможна адсорбция летучих продуктов реакции; возможно проявление диффузионного торможения; кинетические характеристики, как правило, зависят от размеров частиц; возможны затруднения при передаче тепла через продукты реакции.
Некоторые из перечисленных особенностей процессов диссоциации могут быть лимитирующими звеньями, к которым относятся:
1) скорость химического превращения (так называемый кинетический режим);
2) скорость диффузии газа через покровный слой (диффузионный режим);
3) смешанный режим (сопоставимость скоростей химического превращения и диффузии);
4) скорость переноса тепла реакции через покровный слой.
Каждая из указанных стадий может быть выражена аналитически применительно к процессу диссоциации того или иного соединения с учетом его особенностей.
3.4. Окисление твердых металлов
При помещении Ме в атмосферу, содержащую О2 или прочие окислительные газы (СО2, Н2О), поверхность его покрывается окислами, окалиной , толщина которой увеличивается со временем. При высоких температурах данный процесс – высокотемпературная коррозия – развивается весьма быстро и приводит к потере Ме при его нагреве перед прокаткой, ковкой.
Всего из-за окисления Ме ежегодно теряется 18...20 млн т Ме. Окисление Ме – процесс самопроизвольный, но он зависит от ряда факторов.
Процесс окисления состоит из следующих стадий:
1) внешняя диффузия окислительного газа к поверхности окисла;
2) внутренняя диффузия в слое окалины;
3) химический акт (реакция) на границах раздела фаз.
Окалина (МеО) толщиной у находится между двумя средами – между Ме и газом; в ее пределах концентрация О2 падает от границы раздела газ/МеО к границе МеО/Ме, а содержание Ме уменьшается в противоположном направлении. Благодаря этому возможна диффузия веществ в слое окисла, что представлено на рис. 3.7.

Рис. 3.7. Схема окисления металла
Коэффициент диффузии в твердой окалине зависит от ее кристаллического строения, определяемого соотношением мольных долей оксида (VMeO) и Ме (VМе).
При VMе > VMeO образуется пористый слой оксида, через него окислительный газ легко проникает к Ме. Такими свойствами обладают следующие Ме.
MenOn | Na2O | |||
Если VMе < VMeO, то оксид покрывает Ме сплошным плотным покровом, который создает значительное диффузионное сопротивление и окисление затрудняется. К данной группе относятся следующие Ме:
MenOn | Al2O3 | Cu2O | Cr2O3 | Fe2O3 |
|
В условиях реального окисления металла внешняя диффузия газа протекает сравнительно быстро, поэтому процесс окисления какого-либо металла можно представить в виде двух стадий:
1) диффузия О2 (другого окислителя) через оксидную пленку;
2) непосредственно акт химического взаимодействия на границе раздела фаз.
Выведем уравнение зависимости толщины слоя оксида у от времени окисления t при T = const.
Наблюдаемая скорость процесса
Vнабл = dy/dt .
Скорость внутренней диффузии определяется как

где «- » – градиент концентраций;
Спов, Соб – концентрации окислителя на реакционной поверхности и в объеме газа;

Скорость химической реакции определяется как
при n = 1, https://pandia.ru/text/79/398/images/image057_8.gif" width="115 height=52" height="52">
При установившемся режиме скорости последовательных звеньев К и общая скорость равны между собой:
![]()
при этом Спов подставляем в уравнение диффузии:

y = f (t ) – дифференциальное уравнение.
Перенесем и разделим переменные:

Начальные условия: t = 0, y = 0.

Искомая зависимость толщины окисленного диффузионного слоя от времени:
![]() (*)
(*)
Данная функция является параболической.
При t = 0 и y ® 0 , y2 << y, поэтому величиной y2/2 пренебрегаем:
y = Kx C об × t . (3.6)
Данная зависимость линейная.
Отсюда следует:
1) толщина слоя окалины ~ t , т. е. окисление идет с постоянной скоростью;
2) скорость окисления определяется особенностями величины Кх, т. е. реакция находится в кинетической области.
Данное относится к металлам I-й группы.
Для металлов второй группы D < R; при этом t – велико. В этом случае слагаемым пренебрегаем и получаем:
![]()
![]() . (3.7)
. (3.7)
1) толщина слоя окалины пропорциональна , т. е. скорость окисления со временем уменьшается;
2) процесс протекает в диффузионной области.
Графически это показано на рис. 3.8.
Таким образом, у Ме с плотной окалиной реакция окисления вначале находится в кинетической области и слой оксида нарастает по линейной зависимости (на рис. 3.8 – зона 1).
При значительной толщине слоя зависимость становится параболической и процесс лимитируется внутренней диффузией (зона 2). Между этими крайними случаями лежит переходная зона – 3, где y и t связаны дифференциальным уравнением (*), которое учитывает особенности химического превращения и диффузии.

Рис. 3.8. Зависимость толщины окалины от времени процесса: 1 – кинетическая область;
2 – диффузионная область; 3 – переходная зона
4. ПРОЦЕССЫ ВОССТАНОВЛЕНИЯ МЕТАЛЛОВ
4.1. Термодинамическая характеристика процессов восстановления
Получение чистых металлов за счёт диссоциации их оксидов термодинамически маловероятно из-за весьма низких значений упругости диссоциации соединений.
Наиболее целесообразным является процесс получения металлов из их оксидов путём восстановления. Такой процесс по сути является окислительно-восстановительным (окисленный металл восстанавливается, а восстановитель окисляется) и может быть в общем виде описан реакцией
МеО + В = Ме + ВО, D G Т(4.1) , (4.1)
где в качестве восстановителя В может использоваться как твёрдое, так и газообразное вещество (элемент).
Реакция (4.1) по сути, является суммой реакций образования вида
В = = ВО, D G Т(4.2); (4.2)
Ме = = МеО, D G Т(4.3), (4.3)
которые являются экзотермическими.
Самопроизвольное протекание реакции (4.1) возможно, если D G Т(4.2) < D G Т(4.3).
4.2. Восстановление оксидов железа твёрдыми и газообразными
восстановителями
Универсальным восстановителем оксидов железа является твёрдый углерод; при восстановлении газообразными часто применяют СО и Н2.
Термодинамика процессов восстановления оксидов железа твёрдыми и газообразными восстановителями в принципе одинакова.
При использовании окиси углерода СО следует рассматривать равновесия в системе FemOn – CO – CO 2, которые описываются следующими реакциями:
(4.4)
EN-US">EN-US">position:absolute; z-index:5;left:0px;margin-left:234px;margin-top:12px;width:11px;height:88px">
 (4.8)
(4.8)

Рис. 4.1. Равновесный состав газовой фазы системы FemOn – CO – CO 2
На диаграмме отсутствует зона стабильного существования фазы Fe 2O 3, поскольку, согласно расчётам, данная фаза является в рассматриваемом интервале температур неустойчивой уже при содержании СО > 0,01%.
Точка О является точкой нонвариантного равновесия с газовой фазой трёх твёрдых фаз.
При использовании в качестве восстановителя водорода либо какого-нибудь иного восстановителя кривые равновесного состава газа будут рассчитываться аналогично.
При использовании в качестве восстановителя оксидов железа углерода процесс можно описать реакциями, отвечающими равновесию в системе
Fe
2O
3 – Fe
3O
4 – FeO
– Fe
– C
– CO
– CO
2, содержащей семь компонентов.
Однако с учётом нестабильности Fe 2O 3, целесообразно проанализировать следующие химические равновесия:
Fe3O4 + CO = 3FeO + CO2;
FeO + CO = Fe + CO2;
2CO = C + CO2.
Кроме частных равновесий, в соответствии с правилом фаз возможно одновременное равновесие пяти фаз – четырёх твёрдых и газообразной (смеси СО и СО2).
Кривые равновесия указанных реакций приведены на рис. 4.2.
font-size:13.0pt">Рис. 4.1. Равновесные содержания моноксида
углерода при косвенном восстановлении оксидов
железа и реакции газификации твёрдого углерода
Количественные характеристики равновесий в рассматриваемой системе можно получить, решив совместно уравнения, выражающие зависимость констант от состава газовой фазы. Из решения системы этих уравнений следует, что с увеличением давления в системе температуры начала восстановления оксидов железа возрастают, а с понижением давления – наоборот.
Таким образом, фазовые равновесия в системе Fe
–O
в присутствии твёрдого углерода определяются температурой и общим давлением газовой фазы
(СО + СО2).
4.3. Механизм и кинетика процессов восстановления
Механизмы восстановления оксидов металла газами и твёрдыми восстановителями отличны и имеют свои особенности.
При восстановлении газами этот процесс протекает как минимум в три стадии:
1) адсорбция восстановления на реакционной поверхности;
2) переход кислорода от решётки оксида и его соединения с адсорбирующими молекулами восстановителя с одновременным образованием новой твёрдой фазы.
3) десорбция газообразных продуктов восстановления.
Эта теория получила название адсорбционно-автокаталитической, а сам механизм можно представить схемой:
МеО(тв) + В(газ) = МеО(тв) × В(адс),
МеО(тв) × В(адс) = Ме(тв) × ВО(адс),
Ме(тв) × ВО(адс) = Ме(тв) × ВО(газ)
МеО(тв) + В(газ) = Ме(тв) × ВО(газ).
Существует и двустадийная схема, состоящая из этапа диссоциации оксида с образованием молекулярного кислорода и этапа соединения с восстановителем в газовой фазе.
Согласно адсорбционно-автокаталитической теории, процесс восстановления является автокаталитическим – образование твёрдого продукта реакции ускоряет процесс его образования. При этом адсорбция молекул газа-восстановителя развивается по-разному – в зависимости от структуры, строения. На определённом этапе восстановления наблюдается характерный для автокатализа максимум, что соответствует кинетическому режиму восстановления.
Вообще же кинетически процесс восстановления оксидов металлов газами является гетерогенным, состоящим из следующих стадий:
1) внешняя диффузия восстановителя из газового потока к поверхности восстанавливаемого оксида;
2) внутренняя диффузия восстановителя к реакционной доле через поры и дефекты решётки слоя твёрдого продукта восстановителя;
3) химическая реакция с последующим кристаллохимическим превращением оксида металла в более низкий, вплоть до металла;
4) отвод газообразных продуктов восстановления в газовый поток за счёт внутренней и внешней диффузии.
Любая из указанных стадий может быть в принципе лимитирующей, то есть определять скорость процесса восстановления. В зависимости от скорости диффузии и химического превращения возможно ступенчатое либо зональное восстановление, что соответствует принципу последовательности.
Ступенчатый тип процесса наблюдается при кинетическом режиме, зональный – при диффузионном. При сопоставимых скоростях диффузии и химической реакции процесс восстановления будет протекать в смешенном, или диффузионно-кинетическом режиме, являющимся наиболее сложным.
На скорость восстановления газами влияют различные факторы, основными являются следующие: размеры кусков оксидного материала, пористость руд, скорость движения потока газа-восстановителя, состав газа, давление и температура.
Реакции прямого восстановления оксидов металлов являются более сложными по сравнению с восстановлением газами.
Восстановление оксидов твёрдым углеродом можно оценить по реакции
МеО(тв) + С(тв) = Ме(тв) + СО2.
Однако это уравнение не отражает действительного механизма процесса, протекающего в несколько этапов с участием, в качестве промежуточных продуктов, газов.
Существует несколько схем углетермического восстановления оксидов
Двустадийная схема разработана и представлена уравнениями
МеО + СО = Ме + СО2
С + СОг = 2СО
МеО + С = Ме + СО.
Согласно приведенной схеме взаимодействие оксида металла с твердым углеродом сводится к восстановлению газом СО. Это позволяет применить адсобционно-каталитическую теорию для объяснения процессов прямого восстановления, а роль твердого углерода сводится к регенерации СО по реакции газификации. Кинетически по такой схеме возможно восстановление тех металлов, которые легко восстанавливаются газами (Fe , Ni , Cu и т. д.). Нижняя температурная граница взаимодействия по данной схеме связана с малой скоростью реакции газификации углерода при пониженных температурах, и такая стадия часто является лимитирующей. Поэтому решающими для процесса прямого восстановления оксидов металлов являются факторы, влияющие на скорость реакции газификации – температура, активность углерода, наличие катализаторов.
Существует диссоциативная схема, согласно которой возможен процесс диссоциации оксида с последующим взаимодействием кислорода с углеродом по схеме
Ме = Ме + 1/2О2
С + 1/2Ог = СО
МеО + С = Ме + СО.
Такая схема приемлема для оксидов с высокой упругостью диссоциации (Mn О2, Pb О2, Cu О, Сo 3О4).
Оксид – сублимационная схема была разработана, согласно данной гипотезе восстановление ряда оксидов может проходить через возгонку (сублимацию) оксида с последующей конденсацией (адсорбцией) его паров на поверхность углерода:
МеО (тв) = МеО (газ)
МеО (газ) + С (тв) = МеО (адс) · С (тв)
МеО (адс) · С (тв) = Ме (тв) · СО (адс)
Ме (тв) · СО (адс) = Ме (тв) + СО (газ)
МеО (тв) + С (тв) = Ме (тв) + СО (газ).
Данная схема характерна как для летучих оксидов (Mo О3, W О3, Cr 2О3) и объясняет их восстановление при 630…870К, когда взаимодействие по другим схемам из-за малых скоростей реакции газификации углерода и термической диссоциации оксида невозможно, так и для прочных оксидов (Al 2О3, Mg О, Zn О2), возгонка которых сопровождается образованием паров оксидов и низших газообразных оксидов (Al 2О, Si О).
Согласно контактной схеме восстановления, взаимодействие происходит в точках контакта твердых фаз – оксида и углерода. После непосредственного контакта формируется разделяющая прослойка продукта, и восстановление идет с диффузией реагентов через этот слой.
Ряд закономерностей карботермического восстановления объясняется в рамках газокарбидной схемы: влияние СО на скорость процесса, присутствие углерода в продуктах конденсации в зонах, удаленных от реагирующей смеси, эффект разбухания рудно-угольных окатышей, автокатализ.
Таким образом, различные оксиды могут взаимодействовать с углеродом по различным схемам, при этом одновременно с основным механизмом могут реализовываться и другие. Доля каждого механизма в процессе восстановления изменяется в зависимости от условий – температуры, давления, степени смешения реагентов и степени восстановления, прочих факторов.
5 . МЕТАЛЛУРГИЧЕСКИЕ РАСПЛАВЫ
5.1. Общая характеристика
Высокотемпературные металлургические процессы протекают с участием жидких фаз: металлической, оксидной (шлаковой), сульфидной (штейновой), солевой. Взаимодействие между жидкими фазами и с обязательным участием газовой зависит от структуры (строения) и свойств металлургических расплавов.
С учётом природы и строения все жидкости классифицируются следующим образом:
1) с водородными связями (вода, спирты, органические кислоты);
2) с молекулярными связями (бензол, парафин);
3) с ионными связями (оксидные и сульфидные расплавы, водные и прочие растворы солей, щелочей, кислот);
4) с металлическими связями (взаимодействие катионов со свободными электронами).
Участвующие в металлургических процессах оксидные и сульфидные расплавы являются многокомпонентными жидкостями и имеют сложное строение. В расплавах солей, относящихся к ионным жидкостям, наблюдается сильное межчастичное взаимодействие и высокая концентрация частиц в единице объёма. Промышленные металлические расплавы являются многокомпонентными жидкостями, содержащими металлические и металлоидные составляющие.
При получении металлического расплава заданного состава стремятся уменьшить потери легирующих элементов со шлаком и газовой фазой. Это облегчается при знании закономерностей перераспределения элементов между контактирующими фазами, умении рассчитать термодинамическую активность компонентов в металлургических расплавах.
Для решения подобных задач необходимо знать структуру (строение) расплавов и природу сил, действующих между структурными единицами расплава. Для оценки скорости протекающих в системе процессов необходимо знание ряда физико-химических свойств расплавов.
Под структурой или строением расплава понимают количественное описание взаимного расположения в пространстве составляющих их частиц. Структура расплава взаимосвязана с электронной природой частиц, величиной сил взаимодействия между частицами и с его физико-химическими свойствами, которые часто называют структурно-чувствительными свойствами.
5.2. Металлические расплавы
Чистые жидкие металлы обычно относят к так называемым простым жидкостям, которыми являются сжиженные инертные газы с вандерваальскими силами взаимодействия. В жидких металлах межчастичная связь осуществляется коллективизированными электронами; их наличием объясняется электропроводимость , теплопроводность, а также вязкость и адсорбция наряду с другими свойствами металлов.
При температурах, близких к температуре кристаллизации, строение жидких металлов близко к строению твёрдых кристаллических тел. Это сходство заключается в сопоставимости характера межчастичного взаимодействия и термодинамических свойств. В жидком состоянии атомы (ионы) находятся на близких расстояниях, но не образуют строго периодической регулярной структуры, то есть дальнего порядка, характерного для твёрдых кристаллических тел.
Введение в металл различных примесных элементов (в том числе легирующих) изменяет электронное строение расплавов, при этом в зависимости от природы примеси форма его существования в расплаве отличается от формы существования растворителя.
Так, такие элементы, как марганец, хром, никель, другие металлы, мало отличные от железа по электронному строению, обладают неограниченной растворимостью в жидком железе и высокой – в твёрдом. Они образуют с железом твёрдые растворы замещения, при этом занимают часть узлов в кристаллической решётке.
Такие элементы, как углерод, азот и водород, с железом образуют растворы внедрения, при этом располагаясь в междоузлиях кристаллической решётки железа.
Кремний и фосфор в жидком железе растворяются неограниченно, а в твёрдом – их растворимость ограничена. В расплавах железа они образуют обособленные группировки атомов железа с кремнием и фосфором, с преобладанием ковалентной связи.
Растворённые в жидком железе (либо другом растворителе) примеси изменяют свойства металлических расплавов и влияют на характер протекания сталеплавильных процессов. К таким свойствам следует отнести вязкость, поверхностные свойства, плотность, электропроводность и теплопроводность.
5.3. Термодинамические свойства металлических расплавов.
Параметры взаимодействия
Для металлических расплавов, которые по своей сути являются растворами, характерно сложное физико-химическое взаимодействие между частицами, из которых они состоят. Надёжность термодинамического описания металлургических систем определяется степенью разработки той или иной термодинамической теории. При этом в зависимости от характера принятых тех или иных допущений статистические теории делятся на строгие теории (например, квантово-механические); построенные на численном эксперименте теории; модельные теории.
Последние получили достаточно широкое распространение – это теория совершенных растворов, теория идеальных разбавленных растворов, теория регулярных растворов и другие. Одна из причин введения таких теорий – отсутствие общей термодинамической модели растворов.
При описании термодинамических свойств металлических расплавов из используемых моделей наиболее часто используется метод параметров взаимодействия.
Данный метод используется для учета влияния всех компонентов раствора на активность рассматриваемого компонента (например, компонент А – растворитель, компоненты В, С и Д – добавленные примеси). Параметры взаимодействия определяются в результате разложения в ряд Тейлора избыточной свободной энергии ![]() для компонента В около точки, отвечающей чистому растворителю:
для компонента В около точки, отвечающей чистому растворителю:
https://pandia.ru/text/79/398/images/image083_4.gif" width="39" height="25"> по мольным долям элементов примесей называют молярными параметрами взаимодействия первого порядка , вторые – второго порядка https://pandia.ru/text/79/398/images/image086_4.gif" width="28" height="28">.
С учетом этого выражение (5.1) для растворов с невысокими значениями растворенных компонентов (В, С, Д, …) можно записать в виде
Или для i -го компонента
 . (5.2)
. (5.2)
Для многокомпонентных растворов за стандартное состояние вещества обычно принимают 1%-ный разбавленный раствор. В этом случае вместо (5.2) записывают
или в общем виде  (5.3)
(5.3)
здесь 
5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства
Металлургический шлак является многокомпонентным (преимущественно, оксидным) раствором, вступающим во взаимодействие с металлическим расплавом и газовой фазой металлургического агрегата. В состав шлака могут входить сульфиды, фториды, прочие неметаллические включения. По ходу плавки металла шлак выполняет важнейшие технологические функции (например, такие, как защита металла от атмосферы агрегата; поглощение вредных примесей из металла; участие в окислительных процессах; диффузионное раскисление металла).
Строение шлакового расплава определяется природой структурных единиц и их распределением в пространстве. Комплексное изучение основных физико-химических свойств шлаковых расплавов – вязкости, диффузии, адсорбции, проведенное, в том числе при помощи рентгеноструктурных исследований твердых и жидких шлаков, показало, что в расплавленном состоянии шлаковый расплав состоит из ионов – катионов и анионов.
Состав шлаков существенно влияет на их главные свойства, среди которых следует выделить основность – отношение концентрации оксидов с ярко выраженными основными свойствами, и оксидов, обладающих кислотными свойствами. Далее, в зависимости от состава шлаки подразделяются на основные (в них преобладают основные оксиды – CaO , MgO , MnO и др.) и кислые (SiO 2, Al 2O 3, TiO 2).
Состав шлака и его структура влияет на физико-химические свойства: плотность, поверхностные свойства, вязкость, диффузия.
Плотность и мольный объем являются структурно-чувствительными свойствами, данные характеристики используются для расчетов кинетических свойств ионных расплавов. Влияние состава определяется изменением координационного числа и характеризуется изменением свободного объема. Зависимость от температуры связана с изменением межатомного расстояния из-за увеличения амплитуды колебания атомов.
При анализе поверхностных свойств установлено, что для большинства двойных систем поверхностное натяжение линейно меняется с изменением состава.
Другой важнейшей характеристикой шлаковых расплавов является вязкость, изменяющаяся в пределах 0,1…1,0 Па·с (из-за наличия в них крупных структурных единиц типа кремнекислородных комплексов), что выше по сравнению с металлическими расплавами.
Динамическая вязкость η и кинематическое ν связанны соотношением η = 1/ν.
Зависимость вязкости от температуры выражается уравнением
η = Аехр(Еη/RT ),
где Еη – энергия активации вязкостного течения.
Термодинамические свойства шлаковых расплавов описываются при помощи различных теорий – молекулярных и ионных, которые основаны на результатах исследований минералогического состава закристаллизовавшегося шлака и обобщении экспериментальных данных.
Вариант молекулярной теории строения жидких шлаков, разработанный Г. Шенком, отличается простотой и основывается на утверждении, что в качестве единичных структур шлака считаются молекулы свободных оксидов (СаО, SiO 2, FeO …) и их соединений.
Из многообразия соединений оксидов выбраны 5: 2FeO ·SiO 2, 3СаО·Fe 3O 4, 2MnO ·SiO 2, СаО·SiO 2, 4 СаО·Р2О5. Эти соединения удовлетворительно описывают широкий диапазон свойств шлаков, в том числе распределение элементов между металлом и шлаком на основе констант равновесия реакций диссоциаций приведенных соединений.
Однако главная особенность и недостаток молекулярной теории шлаковых расплавов заключается в отсутствии учета реального строения шлаковых расплавов. Тем не менее, накопленный материал позволяет оценивать некоторые термодинамические характеристики – например, активность аi компонентов.
Теория совершенных ионных растворов (автор) основывается на утверждении, что шлаковый раствор полностью диссоциирует на ионы (катионы и анионы); ионы одного знака энергетически равны; ближайшими соседями у каждого иона являются ионы противоположного знака; раствор образуется без изменения объема; при тепловом движении возможны перестановки между ионами одного знака. Активность компонентов такого расплава рассчитывается как произведение ионных долей катионов и анионов.
Например, активность сульфида кальция СаS будет определена по соотношению
![]()
где хСа, хS – ионные доли катиона кальция и анионы серы соответственно.
Теория совершенных ионных растворов может использоваться для определения активностей компонентов в сильно основных шлаках, однако увеличение доли SiO 2 и Al 2O 3 до 20% дает сильное расхождение между теорией и опытом, поэтому в практических расчетах равновесий данная теория не используется.
Однако основные статические положения этой модели применимы в теории регулярных ионных растворов, разработанной и опробованной.
К особенностям данной теории относятся следующие положения: энтропия раствора не считается идеальной и рассчитывается как по теории совершенных ионных растворов; раствор состоит из простейших атомных ионов (катионов – ионов металла Са2+, Fe 2+, Al 3+, и анионов – ионов металлоидов О2–, F –, S 2–); ближайшими соседями ионов являются ионы противоположного знака; раствор образуется без изменения объема, с выделением или поглощением тепла.
При расчетах химических потенциалов компонентов раствора – как и при определении активности компонентов; в данной теории необходимо учитывать энергию смешения компонентов Qij , которая находится на основании результатов экспериментальных исследований растворов из соединений, содержащих катионы i и j . Для данной теории характерно то, что связь между составом и термодинамическими функциями устанавливается более строго и обоснованно, поэтому точность и надежность расчетов выше.
В полимеризационной теории шлаковых расплавов принято, что образующие растворы ионы энергетически неравноценны, при этом образуются полимеризованные комплексы, в которых энергия связи комплексов с другими структурными единицами раствора.
Согласно теории растворов как фаз с коллективной системой электронов (основные положения разработаны) в качестве компонента шлакового раствора выбираются не химические соединения, а элементы периодической системы, поэтому состав раствора выражается в атомных долях. При этом электроны всех атомов раствора образуют единую квантово-механическую систему. Активность соединения Аm Вn в шлаковом растворе определяется как
![]() ,
,
где https://pandia.ru/text/79/398/images/image095_3.gif" width="23" height="25 src="> – активности элементов А и В.
Активность элемента сорта i определяется атомной долей этого компонента и энергией взаимодействия с компонентом j . При этом энергии взаимодействия Еij определяется как
Еij =1/2(χ1/2 – χ1/2)2,
где χi и χj – атомные параметры атомов i и j , определяемые из величин стандартых энтальпий образования различных соединений.
6. ГАЗЫ В СТАЛЯХ. ПРОЦЕССЫ НИТРИДООБРАЗОВАНИЯ
Для высокотемпературных металлургических процессов характерно взаимодействие металлического расплава со шлаковой и газовой фазами. Полнота и скорость взаимодействия газов прежде всего с жидкими металлами определяет качество металлопродукции.
Растворение двухатомных газов (кислорода, водорода и азота) в жидком металле однотипно, подчиняется закону А. Сивертса (известного как закон квадратного корня) и происходит по реакции
Константа равновесия реакции (6.1) имеет вид
, (6.2) где ![]()
Равновесная концентрация газа [Г] в металле при =1 атм называется растворимостью и численно равна константе равновесия реакции (6.1) для двухкомпонентной системы «металл-газ».
При температуре 1600 °С предельная растворимость кислорода в жидком железе составляет 0,22%, для азота – 0,044%, для водорода – 0,0026%.
Процессы растворения газов в большинстве металлов (железе, никеле и др.) являются эндотермическими, поэтому с увеличением температуры растворимость газов возрастает. Исключение составляет растворимость азота в -Fe , которая уменьшается с возрастанием температуры в точках фазовых переходах железа из одной модификации в другую (-Fe -Fe , -Fe https://pandia.ru/text/79/398/images/image102_2.gif" width="13" height="20 src=">-Fe ) и при плавлении (-Fe EN-US">Fe -ж) равновесные концентрации газов в растворе меняются скачкообразно.
Согласно (6.2) на растворимость газов оказывает влияние и давление. С повышением давления равновесие реакции (6.1) смещается в сторону меньшего числа газовых молей, т. е. вправо. Выполнимость закона Сивертса указывает на идеальность образующегося раствора. В присутствии других компонентов, растворенных в металле, равновесные концентрации газов становятся иными. Это влияние можно учесть, используя параметры взаимодействия компонента с растворенным газом.
В случае, когда <0, происходит снижение коэффициента активности газа в расплаве и повышение его растворимости. Например, элементами, повышающими растворимость водорода в железе, являются титан, ниобий, ванадий. Снижению растворимости водорода в железе способствуют такие элементы, как углерод, алюминий , кремний (для них >0).
Почти в такой же последовательности влияют указанные компоненты на коэффициент активности азота и его растворимость.
Сильное снижение растворимости водорода и азота при кристаллизации железа и его сплавов сопровождается рядом нежелательных явлений. Водород в молекулярном виде обособляется в дефектных местах (микропустотах) закристаллизовавшегося металла. С уменьшением размеров этих микродефектов при последующей пластической обработке он создает высокие давления, вследствие чего в металле возникают напряжения, ведущие к снижению пластичности, а также нарушению сплошности.
Влияние легирующих элементов на растворимость азота в расплавах на основе железа или никеля можно оценить при помощи экспериментально установленных .
При взаимодействии азота с расплавами, легированными нитридообразующими элементами, возможно образование раствора Fe-R-N, равновесного с газовой фазой, причем с увеличением содержания R увеличивается растворимость азота.
При определенных содержаниях компонента R из расплава может выделиться тугоплавкое соединение – нитрид RN. Наибольшим сродством к азоту обладают элементы Iva подгруппы Ti, Zr, Hf, которые и используются в основном для связывания азота в жидком металле.
Выделяющиеся из раствора дисперсные карбиды вызывают сильное снижение пластичности металла и повышают его твердость.
Особенности взаимодействия азота с металлическими расплавами отражает диаграмма состояния Me-R-N, фрагмент изотермического сечения которой в областях, богатых металлом, представлен на рис. 6.1.
Линии, ограничивающие области стабильности фаз, описываются соответствующими уравнениями равновесной термодинамики.
Как видно из диаграммы, при небольших количествах нитридообразующего элемента существует двухфазная область стабильности жидкой фазы с газообразным азотом. Координаты линии АВ, разделяющей эту область (I) и область стабильности жидкости (II), можно определить, проанализировав уравнение:
При атм активность азота равна константе равновесия реакции (1). Концентрация азота в точке А равна его растворимости в бинарной системе Me-N.

Рис.6.1. Схема изотермического сечения диаграммы состояния системы Me-R-N
На рис. 6.1 показаны следующие области стабильности фаз:
I – ж + N2,
II – ж,
III – ж + RN,
IV – ж + RN + N 2.
Пересечение изотермы нитридообразования (ВCD) и линии (АВ), соответствующей растворимости азота в расплаве Fe-R-N при font-family:Symbol">- [R] концентрационного треугольника в точке, отвечающей соединению RN, а линия BЕ – в точке, соответствующей чистому азоту при атм.
7. РАСКИСЛЕНИЕ МЕТАЛЛИЧЕСКИХ РАСПЛАВОВ
В процессе окислительного периода плавки стали в сталеплавильном агрегате поступающий в металл кислород (из окислительного шлака, вдуваемый в металлическую ванну газовой струей) расходуется преимущественно на окисление примесей (C , S , P , Si ) и некоторых легирующих компонентов, однако часть его остается в металлическом расплаве.
Растворимость кислорода в железе под чистым железистым шлаком оценивают на основе реакции
(FeO ) = +. (7.1)
![]() .
.
Чипман установил, что для реакции (7..gif" width="176 height=47" height="47">.
При Т = 1600°С (1873К) предельная растворимость кислорода в железе составляет 0,21%.
Однако в реальных условиях плавки сталеплавильные шлаки помимо FeO , содержат многочисленные оксиды и прочие включения, поэтому . Поэтому содержание кислорода в жидкой стали не достигает предела растворимости и находится на уровне 0,06…0,08. При этом при содержании в металлическом расплаве более 0,05…0,06% С содержание кислорода в металле определяется развитием реакции окисления углерода
+ = {CO }. (7.2)
При достижении металлическим расплавом равновесного состояния при Т = 1873 К должно выполняться соотношение · = 0,0025, однако в реальных условиях плавки стали в промышленных агрегатах реакция окисления углерода не достигает равновесия – в частности, из-за условий образования пузырьков СО. В связи с этим по ходу плавки стали под окислительным шлаком содержание кислорода в металле выше равновесного и приближается к нему при содержании углерода менее 0,15%. На рис. 7.1 представлена зависимость содержания кислорода в металлическом расплаве от содержания углерода.

Рис. 7.1 Изменение содержания кислорода в железоуглеродистых расплавах: 1 – равновесная кривая; 2 – область фактических концентраций плавки стали
Фактические концентрации кислорода в стали для всех типов процессов укладывается в одну область. Это свидетельствует, что при > 0,05…0,06 реакция окисления углерода оказывает решающее воздействие на содержание кислорода в стали. При < 0,05…0,06 содержание кислорода в металле соответствует равновесному с углеродом и бывает ниже его. Следовательно, равновесное со шлаком содержание кислорода в Me достигает величин, соответствующих равновесию с углеродом или даже меньше их.
Реакция (7.2) является экзотермической, поэтому при охлаждении и кристаллизации металлического расплава величина · при Р=const уменьшается; избыточные концентрации кислорода оказываются еще большими, что приводит к образованию газовых пузырей, снижающих плотность слитка, и выделению включений оксидов железа и его растворов с сульфидами по границам зерен кристаллизующегося металла. Эти оксисульфиды придают металлу красноломкость в силу низких температур плавления.
Сильное влияние оказывают и ликвация элементов, особенно кислорода: в процессе кристаллизации его содержание в исходном растворе у фронта растущих кристаллов значительно выше среднего в объеме жидкого металла, что вызывает интенсивное окисление углерода.
В связи с этим одной из основных задач заключительного периода плавки является удаление из жидкой стадии избыточного кислорода, что достигается посредством раскисления металлического расплава.
Под раскислением понимают комплекс операций по снижению содержания кислорода в жидкой стали.
Основными задачами раскисления являются:
– снижение содержания кислорода в жидком железе присадками элементов с большим сродством к кислороду, чем у железа, до уровня, обеспечивающего получение плотного металла;
– создание условий для более полного удаления из жидкой стали продуктов раскисления.
Если первая задача рассматривается с использованием законов химической термодинамики, то вторая решается при помощи аппарата химической кинетики.
Термодинамический подход позволяет выявить связь между содержанием кислорода в жидкой стали и содержанием элемента – раскислителя R, определить степень влияния температуры на характер этой связи, а также рассчитать минимальное содержание кислорода в металлическом расплаве при раскислении его элементом R.
Наиболее распространенным способом раскисления является осаждающий, или глубинный метод, согласно которому вглубь металла вводят элементы с более высоким сродством к кислороду (Si , Al , Ca ), чем железо. Эти элементы связывают кислород в прочные неметаллические включения (обычно оксиды), растворимость которых в железе на несколько порядков ниже растворимости FeO . Эти включения обособляются в отдельную фазу в виде мелкой взвеси, которая, имея меньшую плотность по сравнению со сталью, частично всплывает в шлак, а частично остается в закристаллизовавшемся металле в виде неметаллических включений, ухудшая его качество.
Осаждающее (глубинное) раскисление можно описать реакцией вида
![]() . (7.3)
. (7.3)
При условии константа равновесия данной реакции примет вид
 (7.4)
(7.4)
где аi – активность i-го компонента в расплаве.
Для расчета активностей компонентов расплава за стандартное состояние обычно принимают 1%-ный разбавленный раствор.
Диффузионное раскисление достигается при установлении равновесия по реакции
(FeO) = +[O]
В основе метода заложено представление о стремлении к равновесному распределению вещества между несмешивающимися жидкими фазами – Me и шлаками. При этом выполняется соотношение
 (7.5)
(7.5)
При уменьшении активности оксидов железа в шлаке кислород диффундирует в металле к границе раздела фаз и в виде пар ионов Fe 2+ и O 2– переходит в шлак.
Достоинством метода является отсутствие в металле каких-либо продуктов реакции после удаления кислорода.
Данный способ реализуется в ДСП с небольшим количеством шлака и низким содержанием кислорода в газовой фазе. В иных сталеплавильных агрегатах диффузионное раскисление сегодня не применяют из-за малых скоростей процесса.
Чаще всего диффузионное раскисление используют как сопутствующий процесс при обработке жидкой стали в ковше синтетическими известково-глиноземистыми шлаками с низким содержанием FeO (менее 1%). При дроблении металла на мелкие капли поверхность контакта «металл-шлак» увеличивается в тысячи раз, наличие конвективных токов ускоряют процесс не только раскисления, но и десульфурацию стали.
Другим способом раскисления является раскисление вакуумом , в основе которого реакция обезуглероживания С (7.2).
Понижение давления смещает равновесие данной реакции в прямом направлении. Достоинством такого метода является отсутствие в металле продуктов раскисления. Этот способ реализуется при внепечной обработке стали.
Существует комплексное раскисление, основанное на применении комплексных раскислителей – сплавов двух или нескольких компонентов (силикокальций, силикомарганец и др.). Преимущества использования таких раскислителей предопределены существенным улучшением термодинамических условий раскисления и более благоприятными кинетическими условиями зарождения, укрупнения и удаления неметаллических включений.
Так, добавка Mn в Fe при раскислении его кремнием приводит к повышению раскислительной способности последнего.
Эффект увеличения раскислительной способности под влиянием второго компонента объясняется уменьшением термодинамической активности образующегося оксида в сложных продуктах раскисления, которые существенно отличаются от продуктов при раздельном раскислении.
Под раскислительной способностью элемента понимают равновесную концентрацию кислорода, растворенного в железе (металле), соответствующей при данной температуре определенному содержанию этого элемента. Очевидно, что чем меньше эта концентрация при данном содержании раскислителя, тем выше раскислительная способность элемента.
M/n lg [R] - m/n lg fR - lg fO. (7.9)
Приравнивая правую часть уравнения (7.10) к нулю и решая его относительно R, находим концентрацию раскислителя R, соответствующую минимальному содержанию кислорода в металле; при этом значения коэффициентов активности компонентов находим по соотношениям (7.7) и (7.8):
 (7.11)
(7.11)
 (7.12)
(7.12)
Подставляя значение [R] из соотношения (7.12) в уравнение (7.9), определяем минимальную концентрацию кислорода в металлическом расплаве, раскисляемом элементом R:
 (7.13)
(7.13)
На рис. 7.2 представлены раскислительные способности некоторых элементов в жидком железе при Т = 1600 °С.
Содержание кислорода сложно зависит от . При небольших концентрациях раскислителя с увеличением R содержание кислорода понижается. Дальнейшее увеличение приводит к росту концентрации кислорода в металле. Однако при росте содержания кислорода, вызванного уменьшением коэффициента активности, снижается активность кислорода, что подтверждается и экспериментальными данными. Переломы на кривых зависимостях содержания кислорода в жидком железе на рис. 7.1 являются следствием образования разных продуктов раскисления при изменении содержания раскислителя.
Зарождение продуктов раскисления может осуществляться в гомогенной фазе (так называемое спонтанное зародышеобразование) или на готовых поверхностях (поверхности стенок агрегата, шлака, взвешенные включения, оксидные пленки на раскислителях).
Во всех случаях зарождение новых фаз осуществляется в результате флюктуаций – случайного скопления частиц (атом, ионов), отличающихся по составу от среднего содержания в металле. Эти флюктуации в зависимости от их величины и внешних условий могут исчезать или, преодолев некоторый энергетический барьер, развиваться, перерастая во включения.

Рис. 7.2 Раскислительная способность элементов в жидком железе при Т = 1600°С
Экспериментально подтверждено, что в гомогенной системе при формировании зародышей новой фазы в них первоначально переходят имеющие повышенное сродство к кислороду и вызывающие наибольшее поверхностное натяжение на границе раздела фаз «металл – зародыш новой фазы». При последующем росте включений концентрация активных компонентов, участвующих в процессе формирования новой фазы, снижается. Те компоненты расплава, которые способствуют снижению термодинамической активности оксидов, обособляющихся во флюктуации, облегчают формирование зародышей, а способствующие снижению активности раскислителя и кислорода в металле затрудняют их обособление.
В случае зарождения включений на газовых поверхностях существенным, помимо отмеченных выше для гомогенных фаз, является эффект смачивания поверхности обособляющейся фазой. Чем меньше угол смачивания, тем более мелкие флюктуации становятся зародышами. Формирование зародышей облегчается при преимущественном обособлении веществ, капиллярно-активных на границе раздела фаз.
В случае существенного отклонения от равновесного состояния гомогенное зародышеобразование является определяющим. При снижении перенасыщений того или иного компонента возрастает роль готовых поверхностей как центров зародышеобразования. Влияние готовых поверхностей, особенно при выделении твердых включений, тем более эффективно, чем ближе ориентационное и размерное соответствие кристаллов обособляющегося включения и имеющейся подложки.
Зародившиеся включения (их исходный размер порядка 1 нм) укрупняются в результате коагуляции (соединения) частиц при столкновении и выделении на этих частицах вещества из металлического расплава в связи с перенасыщением раствора. На скорость коагуляции влияет частота и эффективность столкновения частиц, которое происходит вследствие броуновского движения, а также из-за различия скоростей движения, что вызывается неодинаковыми размерами и плотностями частиц и наличием конвективных токов
Конвективные токи обеспечивают доставку продуктов раскисления из глубины металла к поверхности раздела «металл – шлак». Перемещение включения у границы металла со шлаком определяется направлением и величиной равнодействующей ряда сил: выталкивающей (архимедовой) F A , обусловленной разностью плотностей металла и шлака и направленной вертикально вверх; капиллярной F кап, вызванной градиентом концентрации капиллярно-активных веществ и направленной в сторону более высокой их концентрации; инерционных – центробежной F Ц, вызванной искривлением траектории и направленной в глубь металла, так как плотность включений меньше плотности стали, и силы инерции F и, направление которой зависит от направления движения частиц: для свободно всплывающих включений она направлена вертикально вверх, а для переносимых потоками – совпадает с направлением потока.
В зависимости от размера и формы включений, раскисленности металла и шлака, гидродинамики потоков, влияние каждой из указанной сил на скорость подхода частицы к поверхности шлака оказывается различным. Крупные включения подходят к границе преимущественно под действием выталкивающей силы, более мелкие – под действием капиллярных, особенно при большом градиенте концентрации кислорода.
С уменьшением поверхности, на которую действуют эти силы, возрастает давление и быстрее реализуется прорыв металлической прослойки. Легче преодолевается такое сопротивление твердыми включениями неправильной формы с острыми гранями, сложнее – с плоскими.
Таким образом, чем полнее раскислена сталь и удалены из нее включения, тем выше качество готового металла.
8. РАСПРЕДЕЛЕНИЕ ЭЛЕМЕНТОВ МЕЖДУ МЕТАЛЛОМ И ШЛАКОМ
Распределение элементов-примесей жидкого металла или какого-либо металла (элемента) между металлической и шлаковой фазами зависит от химического сродства элементов к кислороду, состава шлака, взаимодействие элементов между собой в металле и шлаке, температуры.
Влияние химического состава шлака связано с химическими свойствами оксида, образующегося при окислении элемента-примеси.
Влияние температуры проявляется в зависимости от знака теплового эффекта реакции окисления примеси и перехода оксида в шлак, который, как правило, положителен (ΔН < 0).
Охарактеризовать распределение элементов, происходящее вследствие химической реакции между металлом и шлаком, можно при помощи коэффициента распределения вещества L i .
Этот показатель при определенных условиях может быть количественной характеристикой распределения примеси вследствие окислительной реакции с изменением электронного состояния этой примеси при переходе из одной фазы в другую.
Выразить равновесный показатель распределения можно из константы равновесия реакции окисления элемента, происходящее, например, при взаимодействии контактирующих фаз металлического и шлакового расплавов:
X [ Э] + y (FeO) = (Эx O y ) + y ; (8.1)
 . (8.2)
. (8.2)
С учетом (8.2) коэффициент распределения элемента [Э] выразится в виде:
 . (8.3)
. (8.3)
Анализ уравнения (8.3) позволяет выявить условия перевода элементов из одной фазы в другую: из металла в шлак или наоборот. Ниже рассмотрены примеры распределения некоторых элементов между металлом и шлаком.
Для кремния равновесие реакции межфазного распределения выразится как
2(FeO) = (SiO 2 ) + 2; (8.4)
 .
(8.5)
.
(8.5)
Условия максимального перехода кремния из металлического в шлаковый расплав будут следующие:
1) понижение температуры, позволяющее увеличить величину КSi , так как для данной химической реакции ΔН < 0;
2) увеличение активности (FeO ) в шлаке и окисленности металла [%O ];
3) уменьшение коэффициента активности частиц, содержащих Si , в шлаке;
4) увеличение активности Si в металлическом расплаве.
Условия 2 и 3 выполняются при определенной основности шлака: повышение % CaO снижает коэффициент активности частиц, содержащих Si за счет их группировок с ионами Ca 2+.
Кремний обладает высоким сродством к кислороду, для него EN-US"> 2[P] + 5(FeO) + 4(CaO) = (4(CaO)·(P 2 O 5 )) + 5; (8.6)
 (8.7)
(8.7)
Активность частиц, содержащих фосфор в шлаке, уменьшается при повышении содержания CaO , что связано с образованием группировок типа 4CaO ·P 2O 5. Из анализа (8.6) и (8.7) следует, что для более полного перевода фосфора из металла в шлак необходимо повысить EN-US">FeO , а также CaO . При этом наибольшее влияние одной из этих величин проявляется при повышенных значениях другой.
Условиями максимального перевода фосфора из металла в шлак являются:
1) увеличение активности FeO (ионов Fe 2+ и О2-) в шлаке, что позволяет получить окисленную форму фосфора (P 2O 5);
2) повышение содержания CaO и основности шлака, что позволяет снизить активность частиц в оксидном расплаве, содержащих фосфор;
3) понижение температуры: данный фактор следует учитывать при прочих равных условиях, так как повышение температуры в современных окислительных процессах не снижает возможности удаления фосфора при получении более основных дофосфорирующих шлаков;
4) присутствие в металлическом расплаве элементов, имеющих положительные параметры взаимодействия с фосфором (углерод, кремний, кислород).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Теория металлургических процессов: учебное пособие для вузов / , и др. – М.: Металлургия, 1989. – 392 с.
2. Попель, металлургических процессов: учебное пособие для вузов / , . – М.: Металлургия, 1986. – 463 с.
3. Падерин, и расчеты металлургических систем и процессов: учебное пособие для вузов / , . – М.: МИСИС, 2002. – 334 с.
4. Григорян, основы электросталеплавильных процессов: учебник для вузов / , . – М.: Металлургия, 1989. – 288 с.
5. Казачков, по теории металлургических процессов: учебное пособие для вузов / . – М.: Металлургия, 1988. – 288 с.
Введение ………………………………………………………...…………......…… 3
1. Состав и свойства высокотемпературной газовой атмосферы
1.1. Термодинамика газовых атмосфер ………………………………………… 3
1.2. Гомогенные газовые процессы …………………………………………….. 7
2. Анализ процессов горения твердого углерода ………………………………… 9
3. Оценка прочности химических соединений ………………………………….. 11
3.1. Диссоциация карбонатов ………………………………………………….. 12
3.2. Диссоциация оксидов железа ……………………………………………... 13
3.3. Механизм и кинетика процессов диссоциации ………………………….. 15
3.4. Окисление твёрдых металлов ……………………………………………... 18
4. Процессы восстановления металлов
4.1. Термодинамическая характеристика процессов восстановления …….... 21
4.2. Восстановление оксидов железа твёрдыми и газообразными
восстановителями ………………………………………………………….. 21
4.3. Механизм и кинетика процессов восстановления ……………………….. 23
5. Металлургические расплавы
5.1. Общая характеристика …………………………………………………….. 26
5.2. Металлические расплавы. …………………………………………………. 27
5.3. Термодинамические свойства металлических расплавов. Параметры
взаимодействия ……………………………..……………………………… 28
5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства …29
6. Газы в сталях. Процессы нитридообразования ……………………….……… 31
7. Раскисление металлических расплавов ………………………………………. 34
8. Распределение элементов между металлом и шлаком ………………..…… 40
Библиографический список ……………………………………………………… 43
n1.doc
ФГОУ ВПО
СИБИРСКИЙ УНИВЕРСИТЕТ ФЕДЕРАЛЬНЫЙ
ИНСТИТУТ ЦВЕТНЫХ МЕТАЛЛОВ
И МАТЕРИАЛОВЕДЕНИЯТЕОРИЯ МЕТАЛЛУРГИЧЕСКИХ ПРОЦЕССОВ
КОНСПЕКТ ЛЕКЦИЙ ДЛЯ СТУДЕНТОВ СПЕЦИАЛЬНОСТИ
ИНЖЕНЕР-ФИЗИК
КРАСНОЯРСК 2008
УДК 669.541
ББК 24.5
Рецензент
Утверждено в качестве учебного пособия
И.И.Копач
К 55
Теория металлургических процессов:
Учеб. Пособие для специальности «Инженер-физик»/СФУ. Красноярск, 2008. – 46 с.
ISBN 5-8150-0043-4
В пособии изложены теоретические положения основных процессов металлургического производства, как то: диссоциация, окислительно-восстановительные процессы, химические и физические методы рафинирования, шлаки металлургического производства и металлургия сульфидов.
Сибирский федеральный униаверситет, 2008
В в е д е н и е
ДИССОЦИАЦИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
СОСТАВ И СВОЙСТВА ГАЗОВОЙ ФАЗЫ ПРИ ВЫСОКИХ ТЕМПЕРАТУРАХ.
ОКИСЛИТЕЛЬНО-ОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ.
Восстановление водородом
Восстановление твёрдым углеродом
Восстановление газом СО
Восстановление металлами
4. РАФНИРОВАНИЕ МЕТАЛЛОВ
4.1. Пирометаллургические методы рафинирования
4.2. Физические методы рафинирования
Отстаивание
Кристаллизация
Вакуумное рафинирование
Разделительная плавка.
Конвертирование штейнов.
Строение шлаковых расплавов
В В Е Д Е Н И Е
Теория металлургических процессов – это физическая химия, описывающая поведение химически реагирующих систем при высоких температурах, в пределах от 800 до 2500 К и более.
Ускоренный прогресс человечества начался после того как люди научились использовать металлы. Уровень рзвития страны и в настоящее время в значительной степени определяется уровнем развития металлургической, химической и добывающих отраслей. В настоящее время пути экстенсивного развития практически исчерпаны и на первое место встал вопрос об интенсивном развитии всех отраслей производства, в том числе и металлургии. Последние десятилятия характеризуются качественно новыми подходами ко всем производственным процессам, это:
энерго – и ресурсосбережение,
глубокая переработка сырья и техногенных отходов,
использование новейших достижений науки в производстве,
использование микро- и нанотехнологий,
автоматизация и компьютеризация производственных процессов,
минимизация вредных воэдействий на окружающую среду.
Перечисленные (и многие другие) требования предъявляют высокие требования к уровню фундаментальной и специальной подготовки современного инженера.
Предлагаемое учебное пособие по теории металлургических процессов является попыткой изложения дисциплины на первом, наиболее низком уровне сложности, т.е. без математических доказательств, с минимальным обоснованием исходных положений и анализом получаемых результатов. Пособие состоит из 6-ти глав, охватывающих практически весь процесс получения металлов из руд и концентратов.
Вначале вспомним известный из школьного курса химии доменный процесс выплавки чугуна из железной руды или железорудных концентратов. В доменной печи существуют три фазы:
газовая фаза, состоящая из газов СО, СО 2 , паров металлов и оксидов,
шлаковая фаза, состоящая из расплавленных оксидов CaO, SiO 2 , Al 2 O 3 , FeO, MnO и др.
металлическая фаза, состоящая из жидкого железа и растворённых в нём примесей, таких как углерод, марганец, кремний, фосфор, сера и др.
В настоящее время металлургия получает около 70 металлов, которые принято подразделять на цветные и черные. К последним относят всего 4 металла: железо, марганец, ванадий и хром. Группа цветных металлов более многочислена, поэтому подразделяется на следующие подгруппы.
Тяжёлые: медь, свинец, цинк, никель, олово, ртуть, всего 18 элементов.
Лёгкие металлы: алюминий, магний, титан, кремний, щёлочные и щёлочноземельные металлы, всего 12 элементов.
Благородные: золото, серебро, платина и др. всего 8 элементов, своё название они получили из-за отсутствия сродства к кислороду, поэтому в природе находятся в свободном (неокисленном) состоянии.
Редкие металлы: тугоплавкие – 5 элементов, редкоземельные – 16 элементов и радиоактивные – 16 элементов.
пирометаллургические,
гидрометаллургические и
электрометаллургические процессы.
Первые из них протекают при температурах порядка 1000 – 2500 К при этом компоненты находятся в расплавленном и растворённом состояниях.
Вторые протекают в водных, реже в органических, растворителях, при температурах 300 – 600 К. Многие гидрометаллургические процессы протекают также и при повышенных давлениях, т.е. в автоклавах.
Электрометаллургические процессы протекают на электродах как в водных растворах, так и в солевых расплавах при различных температурах. Например, электролиз глинозёма в криолит-глинозёмном расплаве протекат при 1230 К, а электролиз платины из водного электролита – при 330 К.
Сырьём для производства многих металлов являются, прежде всего, окисленные руды, из них получают алюминий, железо, хром, марганец, титан, частично медь, никель, свинец. Из менее распространённых сульфидных руд получают такие металлы как медь, свинец, никель, кобальт, и благородные металлы. Из хлоридных руд (из вод морей и озёр) получают магний, кальций и щелочные металлы.
Металлургические производства оказывают вредное воздействие на окружающую среду, а именно:
выбросы реакционных газов, таких как CO, SO 2 , SO 3 , Cl, CS 2 и многие другие газы,
плевидые и жидкие частицы различной крупности и состава,
слив больших объёмов промышленных вод, загрязняющих водные объёкты, в том числе и питьевого водоснабжения.
большой сброс избыточной, малоценной энергии, которая может быть использована для обогреве теплиц и пр.
Приближённая оценка показывает, что человек, добирающийся на работу в общественном транспорте, расходует примерно на порядок меньше горючего и кислорода, в сравнении с любителями комфорта, едущими в одиночестве в автомобиле с рабочим объёмом двигателя в несколько литров. Будущее человечества, как мыслящего сообщества, находится на пути сознательного самоогрничения в сфере потребления товаров, услуг и, в конечном счёте – энергоресурсов.
Металлургия черных металлов
Скачать книгу в формате «djvu» вы можете в конце описания.
Раздел первый. МЕТАЛЛУРГИЯ ЧУГУНА
Глава I. Сырые материалы доменной плавки
§1. Требования к шихтовым материалам
§ 2. Железные руды
§ 3. Марганцевые руды
§ 4. Флюсы
§ 5. Отходы производства
§ 6. Топливо доменной плавки
Глава II. Подготовка железных руд
§1. Дробление и измельчение руды
§ 2. Сортировка руды
§ 3. Обогащение руды
§ 4. Окускование железных руд и концентратов
§ 5. Производство окатышей
Глава III. Устройство доменной печи
§ 1. Шахта и горн доменной печи
§ 2. Колошниковое устройство
§ 3. Подача шихты в доменную печь
§ 4. Автоматизация доменной печи
§ 5. Разливка чугуна и шлака
§ 6. Разливочные машины
§ 7. Подача воздушного дутья в печь и его нагрев
§ 8. Очистка доменного газа
Глава IV. Доменный процесс
§ 1. Движение материалов в доменной печи
§ 2. Нагрев шихты
§ 3. Удаление влаги и летучих
§ 4. Разложение углекислых соединений
§ 5. Восстановление оксидов железа
§ 6. Восстановление кремния и выплавка кремнистых чугунов
§ 7. Восстановление марганца и выплавка марганцовистых чугунов
§ 8. Образование чугуна и шлака в доменной печи
§ 9. Поведение фосфора
§ 10. Поведение серы
§ 11. Процессы сгорания топлива в горне доменной печи
§ 12. Методы интенсификации доменного процесса
§ 13. Продукты доменной плавки
§ 14. Технико-экономические показатели доменного процесса
Глава V. Прямое получение железа
§ 1. Восстановление газом в толстом слое
§ 2. Восстановление твердым углеродом
Раздел второй. МЕТАЛЛУРГИЯ СТАЛИ
§1. Классификация стали
Глава VI. Физико-химические основы производства стали
§ 1. Общие сведения по физической химии, используемые при изучении металлургии стали
§ 2. Шлаки сталеплавильных процессов
§ 3. Основные реакции сталеплавильных процессов
Глава VII. Производство стали в конвертерах
§ 1. Краткая характеристика бессемеровского и томасовского производства стали
§ 2. Сущность кислородно-конвертерного процесса
§ 3. Кислородно-конвертерный процесс с верхней продувкой
§ 4. Кислородно-конвертерный процесс с дойной продувкой
§ 5. Конвертерный процесс с комбинированной продувкой
§ 6. Конвертерный передел высокофосфористых чугунов
§ 7. Очистка кислородно-конвертерных газов
§ 8. Контроль плавки и автоматизация процесса
§ 9. Качество стали и технико-экономические показатели кислородно-конвертерного процесса
§ 10. Устройство кислородно-конвертерных цехов
Также вас может заинтересовать:
Глава VIII. Производство стали в мартеновских печах
§ 1. История развития мартеновского процесса
§ 2. Сущность мартеновского процесса
§ 3. Устройство мартеновской печи
§ 4. Тепловая работа и топливо мартеновской печи
§ 5. Разновидности мартеновского процесса
§ 6. Основной мартеновский процесс и его разновидности
§ 7. Кислый мартеновский процесс
§ 8. Технико-экономические показатели мартеновского процесса
§ 9. Двухванные сталеплавильные печи
Глава IX. Производство стали в электрических печах
§ 1. Устройство дуговых электропечей
§ 2. Плавка стали в основной дуговой электропечи
§ 3. Плавка в кислой электропечи
§ 4. Индукционные печи и плавка в них
Глава X. Применение вакуума в производстве стали и сплавов
§ 1. Выплавка стали в вакуумных печах
§ 2. Обработка жидкой стали в вакууме
§ 3. Специальные методы электрометаллургии
Глава XI. Разливка стали
§ 1. Разливка стали сверху
§ 2. Разливка стали сифоном
§ 3. Оборудование для разливки стали
§ 4. Технология разливки
§ 5. Разливка стали на УНРС
§ 6. Понятие о кипящей, спокойной и полуспокойной стали
§ 7. Строение стальных слитков
§ 8. Химическая неоднородность и пороки стальных слитков
Глава XII. Производство ферросплавов
§1. Устройство ферросплавных печей
§2. Технология производства ферросилиция
§3. Производство углеродистого ферромарганца
§4. Производство углеродистого феррохрома
§5. Металлотермический способ производства ферротитана
Раздел третий. ОБРАБОТКА МЕТАЛЛОВ ДАВЛЕНИЕМ
Глава XIII. Пластическая деформация и основы теории прокатки
§1. Силы и напряжения
§2. Схемы напряженного состояния и схемы деформации
§3. Уравнение пластичности
§4. Пластическая деформация металлов и сплавов в горячем и холодном состоянии
§5. Пластическое изменение формы кристаллических тел
§6. Неравномерность деформации
§7. Постоянство объема металла и коэффициенты деформации
§8. Дислокации
§9. Закон наименьшего сопротивления
§10. Основы теории прокатки
§11. Условие захвата металла валками
§12. Роль трения при прокатке. коэффициент трения при пластической деформации
§13. Зависимость рабочего диаметра валков от степени деформации и коэффициента трения
§14. Уширение при прокатке
§15. Опережение при прокатке
§16. Усилие прокатки
§17. Направление сил, действующих на валки, и момент прокатки
§18. Экспериментальное определение усилия прокатки
Глава XIV. Нагрев металла перед прокаткой и нагревательные устройства
§1. Температура нагрева стали перед прокаткой
§2. Скорость нагрева металла
§3. Температура металла в конце прокатки
§4. Охлаждение стали после прокатки
§5. Нагрев слитков
§6. Нагрев заготовок
Глава XV. Основное и вспомогательное оборудование прокатных станов
§1. Главная линия прокатного стана
§2. Классификация прокатных станов
§3. Классификация рабочих клетей прокатных станов
§4. Оборудование главной линии прокатного стана
§5. Вспомогательное оборудование прокатных станов
Глава XVI. Технология прокатки
§1. Подготовка слитков и заготовок к прокатке
§ 2. Калибровка валков
§ 3. Контроль технологического процесса
§ 4. Технологические схемы прокатного производства на металлургическом заводе
§ 5. Производство блюмов
§ 6. Производство заготовок
§ 7. Производство крупносортной стали
§ 8. Производство среднесортной стали
§ 9. Производство мелкосортной стали
§ 10. Производство катанки
§ 11. Производство рельсов и балок
§ 12. Станы специального назначения
§ 13. Технико-экономические показатели работы сортовых прокатных станов
§ 14. Производство толстолистовой стали
§ 15. Производство широко-полосовой стали
§ 16. Производство холоднокатаных листов и лент
§ 17. Производство проката из металлических порошков
§ 18. Технико-экономические показатели работы листовых прокатных станов
Глава XVII. Производство бесшовных и сварных труб
§ 1. Производство бесшовных труб
§ 2. Производство труб на автоматическом стане
§ 3. Производство труб на непрерывном стане
§4. Производство холоднокатаных труб
§ 5. Производство труб методом непрерывной печной сварки
§ 6. Производство электросварных труб
Глава XVIII. Волочильное производство
§ 1. Основы теории волочения
§ 2. Волоки
§ 3. Смазка при волочении
§ 4. Технологический процесс производства проволоки
§ 5. Машины для волочения проволоки
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН РГП «КАРАГАНДИНСКИЙ ГОСУДАРСТВЕННЫЙ ИНДУСТРИАЛЬНЫЙ УНИВЕРСИТЕТ» КАФЕДРА «МЕТАЛЛУРГИЯ И МАТЕРИАЛОВЕДЕНИЕ» Программа вступительного экзамена в магистратуру по специальности 6М070900 - «Металлургия» Темиртау, 2013 1. Основы теории металлургических процессов. Деление металлов на черные и цветные. Основные законы физикохимического равновесия, используемые в производстве металлов и сплавов. Расчетные характеристики равновесия. 2. Исходные материалы металлургического производства и их подготовка. Руды. Общая характеристика руд. Топливо для металлургического производства, твердое, жидкое и газообразное Подготовка руд к плавке. Принципиальные схемы обогащения, дробления и окускования руд. Процессы протекающие при агломерации руд. Основные компоненты шихт 3. Производство чугуна. Общая схема производственного процесса. Профиль доменной печи. Основные элементы и их назначение. Флюсы и топливо доменной плавки. Восстановление окислов железа и разложение углеродистых соединений. Восстановление кремния и марганца. Процессы в горне доменной печи. Образование шлака и его физические свойства. Удаление серы. Технико-экономические показатели. 4. Производство стали. Классификация сталей. Способы получения. Шихтовые материалы сталеплавильного производства. Металлическая и неметаллическая группа. Термодинамика и кинетика сталеплавильных процессов. Сталеплавильные шлаки. Источники их образования. Физико-химические свойства. Основные реакции сталеплавильных процессов. Поведение кремния, марганца, серы и фосфора. Газы и неметаллические включения в стали. Способы удаления. Раскисление легирование стали. Способы раскисления. 5. Производство стали в конверторах. 2 Общие принципы и разновидности конвертерных процессов. Принципиальная схема LD-процесса. Основные элементы конструкции. Общие принципы ведения плавки LD-процессом. ТЭП процесса. 6. Подовые процессы. Схема работы мартеновской печи. Основные элементы печи. Разновидности процесса. Окислительный характер газовой фазы. Топливо. Периоды плавки. Окисление примесей. Ход плавки при основном скрап-рудном и скрап процессах. Взаимосвязь тепловой работы печи и скорости окисления углерода. Разновидности мартеновского процесса. Интенсификация плавки кислородом. Двухванные печи. Качество стали и технико-экономические показатели процесса. 7. Выплавка стали в электропечах. Конструктивные элементы ДСП. Электрическая схема. Электроды. Технологические особенности выплавки стали в основной ДСП. Периоды плавки. Разновидности технологии плавки в большегрузных печах. 8. Выплавка стали в переплавных электропечах. Выплавка стали в индукционных печах. Достоинства технологии в сравнении с ДСП. Процессы ЭШП, ВДП. 9. Производство ферросплавов. Основы технологии производства малой группы ферросплавов на основе Ti, V. Технико-экономические показатели процессов. 10. Производство цветных металлов. Общие сведения. Способы получения (пиро-, гидро- и электрометаллургические). Металлургия меди. Схема пирометаллургического способа получения меди. Обжиг концентратов и плавка на штейн в отражательных и электрических печах. Конвертирование медных штейнов. Рафинирование меди. 3 11. Металлургия алюминия. Металлургия алюминия. Сырые материалы и способы производства алюминия. Схема получения алюминия. Производство глинозема. Рафинирование алюминия. 12. Производство тугоплавких металлов. Производство тугоплавких металлов. Хлоридные методы производства металлов. Основы производства титана. Сырье. Получение тетрохлорида титана. Йодидный способ получения титана. Производство тугоплавких металлов. Технология получения вольфрама. Обогащение руд. Схема переработки вольфрамового концентрата. Получение порошка металлического вольфрама из WO3. 13. Внедоменное получение железа. Общая характеристика процессов внедоменного получения железа. 14.Шахтный восстановительно-плавильный процесс. Производство губчатого железа в шахтных печах. 15.Производство губчатого железа в периодически действующих ретортах. Принцип работы агрегата, применяемое сырье и топливо. Преимущества и недостатки способа. 16. Получение губчатого железа в кипящем слое Принцип работы агрегата, применяемое сырье и топливо. Преимущества и недостатки способа. 17. Производство губчатого железа во вращающейся печи Принцип работы агрегата, применяемое сырье и топливо. Преимущества и недостатки способа. 4 18. Производство губчатого железа в проходных печах Принцип работы агрегата, применяемое сырье и топливо. Преимущества и недостатки способа. 19. Порошковая металлургия Классификация изделий порошковой металлургии и основные понятия. 20. Свойства металлических порошков. Технологические, химические и физические свойства. 21. Получение порошков. Методы механической обработки и физико-химические методы. 22. Подготовка порошкообразных материалов к формовке. Классификация, усреднение, смешивание и оборудование для проведения этих операций. 23. Общие представления и теоретические основы процесса формовки. Пластические деформации, уплотнения в зависимости от свойств порошковых материалов. Дозировка компонентов, смешивание. Оборудование применяемое при формовке. 24. Брак при прессовании и факторы, способствующие его появлению. Причины возникновения брака и методы устранения. 25. Прокатка порошков. Метод применяемый при получении определенных изделий. 5 РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА Основная литература: 1. Воскобойников В.Г., Кудрин В.А., Якушев А.м. Общая металлургия. – М.: ИКЦ «Академкнига». 2002. – 786с. 2. Арсентьев М.П., Яковлев В.В., Крашенинников М.Г. и др. Общая металлургия. – М: металлургия. 1986.-360 с. 3. Явойский В.И., Кряковский Ю.В., Григорьев ВП. и др. Металлургия стали. М. «Металлургия», 1983, 583 с. с илл. 4. Бигеев А.М, Бигеев В.А., Металлургия стали. Магнитогорск, МГТУ, 2000 – 542 с. 5. Кудрин В.А. Теория и технология производства стали. – М.: Мир. 2003 – 528с. 6. Борнацкий И.И., Михневич В.Ф., Яргин С.А. Производство стали. М.: Металлургия.1991. – 400 с. 7. Соколов Г.А. Производство стали. М., «Металлургия», 1982, 496с. с илл. 8.Шишкин Ю.И., Торговец А.К., Григорова О.А. Теория и технология конвертерных процессов. Алматы. Гылым. 2006. – 192 с. 9. Борнацкий И.И.,. Михневич В.Ф,.Яргин С.А. Производство стали. М., “Металлургия”, 1991, 400 с. 10. Шишкин Ю.И., Лукин Г.П. Металлургические расчеты, Алматы РИК., 2002. – 115с. 11. Рысс М.А. Производство ферросплавов.-М:Металлургия. 1985-344с. 12. Попель С.И., Сотников А.И., Бороненков В.Н. Теория металлургических процессов.-М:Металлургия, 1986.-464с. 13. Агеенков В.Г., Михин Я.Я. Металлургические расчеты. М: Металлургия.1962,-208с. 14. Еднерал Ф.П., Филиппов А.Ф. Расчеты по электрометаллургии стали и ферросплавов. –М.:Металлургиздат, 1978.-230 с. 6 15. Крамаров А.Д., Соколов А.Н. Электрометаллургия стали и ферросплавов. –М.: Металлургия, 1976.-375с. 16. Торговец А.К., Шишкин Ю.И. Артыкбаев О.А. Теория, технология и оборудование внепечной обработки металлов.-Алматы.: Гылым, 2004.-273с. 17. Севрюков Н.Н., Кузьмин Б.А., Челищев Е.В. Общая металлургия.М.:Металлургия, 1976.-568с. 18. Общая металлургия (металлургия черных и цветных металлов). Под редакцией Е.В.Челищева. - М: Металлургия,1971.-480с. 19. Князев В.Ф. Бескоксовая металлургия железа. М: Металлургия, 1972 20. Тлеугабулов С.М. Теоретические основы получения металлов, сплавов и перспективных материалов. Алматы: издание РИК по учебной и методической литературе, 2001 г, 332 стр. 21. Кипарисов С.С., Либенсон Г. Порошковая металлургия. Учебник. М. «Металлургия», 1997. Дополнительная литература 1. Ишмухамедов Н.К. Черная металлургия Казахстана. Алматы.: НИЦ. «Гылым», 2002.-50с. 2. Электрометаллургия стали и ферросплавов. Под редакцией ДоволоцкогоД.Я. М.: Металлургия, 1984.-438с. 3. Гасик М.И., Лякишев Н.П. Емлин Б.И. Теория и технология производства ферросплавов. –М.:Металлургия,1988.-784с. 4. Шишкин Ю.И., Польшиков Г.В., Богомяков В.И. Эффективность использования извести при переделе фосфористых чугунов в большегрузных конвертерах.-Караганда.: Союз научных и инженерных обществ СССР,1991.-43с. 5. Явойский В.И, Левин С.Л., Баптизманский В.И. и др. Металлургия стали.М.:Металлургия 1973.-816с. с илл. 6. Меджибожский М.Я. Основы термодинамики и кинетики сталеплавильных процессов. Киев, “Виша школа”, 1979, 276 с. с илл. 7 7. Линчевский Б.В., Соболевский А.Л., Кальменев А.А. Металлургия черных металлов. – М.: Металлургия, 1986. – 360с. 8. Пономарева К.С. Сборник задач по физической химии.- М.: Металлургиздат, 1962.-232с. 9. Арсентьев М.П., Яковлев В.В., Крашенинников М.Г. и др. Общая металлургия. – М: Металлургия. 1986.-360 с. 10. Тлеугабулов С.М. Теория и технология твердофазного восстановления железа углеродом. Алматы: Гылым, 1992. 311 с. 11. Кипарисов С.С., Либенсон Г. Порошковая металлургия. Учебник. М. «Металлургия», 1972, 528 с. 8